Miércoles 29 de Junio de 2011
Hoy ha sido un intenso día de trabajo y de adquisición de nuevos conocimientos. Nuestro objetivo de este miércoles ha consistido en calcular la viscosidad de las dos muestras que preparamos el día anterior junto a una nueva muestra de leche desnatada de tetrabrik. Esto es debido a que queremos comprobar si el hecho de que la leche desnatada sea en polvo o no influye en la diferencia de viscosidad que esta presenta con respecto a la leche entera.
El reómetro lo utilizaremos en las mismas condiciones que el día anterior ( disculpas por no haberlas explicado detalladamente). La temperatura que utilizaremos será constante con un valor de 25ºC y aplicaremos sobre la muestra un gradiente de velocidad entre 0-120 1/s. Una vez colocada la muestra en el recipiente dejaremos un total de 5 min de reposo antes de comenzar la agitación de la misma. La agitación durara un periodo de otros 5 min más. Para conseguir una mayor precisión de los datos realizaremos dos medidas de cada muestra de las cuáles obtendremos la media y su desviación.
Nuestra idea central este miércoles es comprobar si se produce una diferencia notable al sustituir la leche desnatada en polvo por la leche desnatada de tetrabrik, es decir si la diferencia de la viscosidad entre la leche desnatada de tetrabrik y la leche entera es mayor que entre la leche desnatada de polvo y otra vez la leche entera.
Pero nos ha surgido un problema: NUESTRO RESULTADO HA SIDO QUE LA VISCOSIDAD DE LA LECHE DESNATADA ES SUPERIOR A LA LECHE ENTERA. Como se puede comprobar a simple vista la fluidez de la leche desnatada es mayor a la de la leche entera, incluso se puede detectar en la impresiones mecánicas que percibimos en la boca al ingerirla. Por lo tanto es IMPODIBLE que los datos obtenidos por el reómetro sean precisos y plausibles.
Solución: Volver a repetir las medidas tanto de la leche entera como de la leche desnatada de tetrabrik. Pero el problema no se ha podido solucionar porque los datos aun continuado constantes con lo que hemos tenido que excluir de nuestro proyecto la muestra de la leche desnatada en tetrabrik para obtener unos resultados fiables que coincidiesen con la realidad.
Después de terminar con los cálculos de las viscosidades hemos podido utilizar otro aparato del laboratorio general denominado medidor del tamaño de las partículas. Aquí podéis ver una imagen del mecanismo completo.

El medidor del tamaño de las partículas nos informa de la distribución de a población de las partículas de la muestra mediante la difracción láser. Por lo tanto se atraviesa la muestra con dos haces de luces y recoge la luz al otro extremo de la muestra. Esta luz recogida varia según la obscuración de la muestra que dependerá el tamaño de las partículas presentes en dicha muestra. Cuanto mayor sea el tamaño de las partículas menor será la cantidad de luz recogida y viceversa.
Su uso: Se mezcla la muestra, en este caso la leche, en agua o en cualquier otro tipo de sustancia, que nos servirá de referencia para detectar los cambios que se producen al introducir la muestra. Obtendremos después de unos segundos la curva de granulométrica de la muestra.

Hemos medido las partículas existentes en la muestra de leche entera, leche desntada de polvo y la leche desnatada de tetrabrik y hemos obtenido los siguientes resultados:
– Leche entera: una única población de grasa y proteínas unidas entre si.
-Leche desnatada de tetrabrik: dos poblaciones perfectamente definidas una de grasa y otra de proteínas.
-Leche desnatada de polvo: tres poblaciones, producidas por la manipulación de los polvos de la leche antes de la consumición.
El medidor del tamaño de las partículas se utiliza en un ámbito industrial para asegurar la calidad del producto promocionado.
Por último hemos calculado la densidad de la leche desnatada mediante un picnómetro.

El picnómetro o botella de gravedad específica “es un frasco con un cierre sellado de vidrio que dispone de un tapón provisto de un finísimo capilar, de tal manera que puede obtenerse un volumen con gran precisión. Esto permite medir la densidad de un fluido, en referencia a la de un fluido de densidad conocida como el agua”
Para calcular la densidad de las muestras utilizamos la siguiente fórmula:
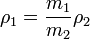
m1: masa de muestra (leche) contenido en el picnómetro.
ρ1: densidad de la muestra contenido en el picnómetro
m2: masa de agua(o líquido de densidad conocida) contenido en el picnómetro
ρ2: densidad del “agua”(o líquido de densidad conocida) contenido en el picnómetro
Antes de irnos del laboratorio hemos obtenido las gráficas de la viscosidad de las muestras y hemos comenzado con la presentación del polimedia.
Nos vemos mañana